小麦穗部激素应答的转录组图谱研究取得新进展
作者: 审稿人:刘宇娇 时间: 2019-05-28 点击次数:次
激素是调控植物生长、发育以及应答生物和非生物胁迫的关键信号分子。激素应答转录组图谱对于理解激素调控植物生长发育及应答胁迫的分子机制具有重要参考价值。目前,已有拟南芥(Goda et al. 2008)、水稻(Garg et al. 2011)以及短柄草(Kakei et al. 2015)等模式植物的激素应答转录组图谱。但是,由于物种的差异和普通小麦基因组的复杂性,模式植物的结果不能为小麦激素相关研究提供准确有效的参考信息。
穗是小麦最重要的器官之一。构建小麦穗部激素应答的转录组图谱,对穗部相关性状(赤霉病抗性、穗发芽抗性、产量、品质等)的研究具有重要意义。
本研究分析了小麦穗部基因表达对7种主要植物激素【生长素(IAA)、赤霉素(GA)、脱落酸(ABA)、细胞分裂素(CK)、乙烯(ET)、水杨酸(SA)和茉莉酸(JA)】的应答情况,构建了小麦穗部激素应答的转录组图谱,并将其与小麦穗部生物胁迫(赤霉病)和非生物胁迫(干旱)的转录组数据进行比较分析,获得如下结果:
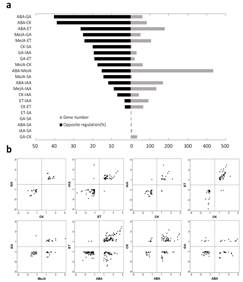
(1)外施激素24 h后,提取穗部总RNA,芯片检测基因表达,共获得3386个差异表达基因(DEG)。其中,应答ABA的基因最多(1425个上调,897个下调);应答SA的基因最少(2个上调,11个下调)。22.7%的DEG可以被至少两种激素所调控,IAA、ET和GA分别与CK共同调控的基因呈现高比例的相同的表达模式,展现了转录水平的协同作用;ET、CK和GA分别与ABA共同调控的基因呈现高比例的相反表达模式,展现了转录水平的拮抗作用。利用RT-qPCR验证了44个基因的表达情况,证明芯片检测数据可靠。成功鉴定了小麦穗部特异响应各种激素的标记基因(marker gene)。

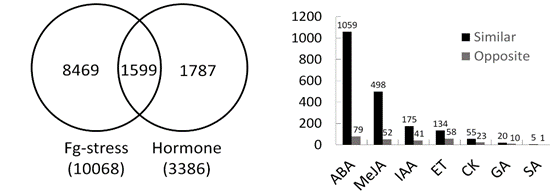
2. 赤霉病是发生在小麦穗部的一种严重病害,其主要致病菌是禾谷镰刀菌(Fusarium graminearum)。我们前期初步研究了多种植物激素对小麦赤霉病抗性的影响(Qi et al. 2012, 2016, 2018, 2019),结果表明F. graminearum侵染后,穗部ABA、JA和SA含量均显著增加。但是,向穗部外源施加ABA和JA分别减弱和增强小麦的赤霉病抗性,但施加SA不影响宿主的赤霉病抗性。本研究综合分析转录组数据,鉴定了1599个与响应激素和赤霉病的DEG;发现这些DEG主要涉及ABA和JA应答,而SA应答基因极少,这进一步解释了SA为什么不能有效诱导小麦赤霉病抗性;基因富集结果表明ABA和JA均上调与氧化还原途径和多种抗性相关途径基因的表达。但是,ABA抑制与植物免疫和次生细胞壁合成密切相关的苯丙醇途径,这可能是ABA抑制小麦赤霉病抗性的主要原因之一。
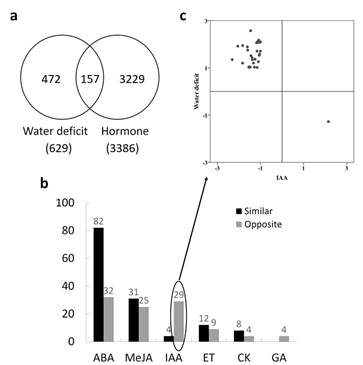
3. 穗是小麦重要的光合器官之一。干旱会影响植物的光合作用效率,植物可通过调控内源激素信号响应干旱胁迫。结合小麦颖壳干旱胁迫的转录组数据(Liu et al. 2017),我们对相关的激素调控过程进行了分析。结果表明,干旱胁迫可增强颖壳的ABA信号,抑制IAA信号途径。
综上,本研究提供了一个小麦穗部激素应答的转录组图谱,并证明其有助于解析植物激素在小麦穗部相关性状的作用。本研究鉴定的激素特异应答基因将有助于快速准确检测特定激素信号途径的响应强度,为小麦激素相关研究提供了简单可靠的标记。
2019年5月20日BMC genomics杂志在线发表了四川农业大学小麦研究所这一研究成果(https://doi.org/10.1186/s12864-019-5726-x)。该研究得到国家自然科学基金、国家重点研发计划等资助。
参考文献
Qi PF, Jiang YF, Guo ZR, et al. Transcriptional reference map of hormone responses in wheat spikes. BMC Genomics, 2019, 20: 390. https://doi.org/10.1186/s12864-019-5726-x
Qi PF, Zhang YZ, Liu CH, et al. Functional analysis of FgNahG clarifies the contribution of salicylic acid to wheat (Triticum aestivum) resistance against Fusarium head blight. Toxins, 2019, 11: 59
Qi PF, Zhang YZ, Liu CH, et al. Fusarium graminearum ATP-bing cassette transporter gene FgABCC9 is required for its transportation of salicylic acid, fungicide resistance, mycelial growth and pathogenicity towards wheat. International Journal of Molecular Sciences, 2018, 19: 2351
Qi PF, Balcerzak M, Rocheleau H, et al. Jasmonic acid and abscisic acid play important roles in host–pathogen interaction between Fusarium graminearum and wheat during the early stages of Fusarium head blight. Physiological and Molecular Plant Pathology, 2016, 93: 39-48.
Qi PF, Johnston A, Balcerzak M, et al. Effect of salicylic acid on Fusarium graminearum, the major causal agent of fusarium head blight in wheat. Fungal Biology (2012) 116:413-426
Garg R, Tyagi A K, Jain M. Microarray analysis reveals overlapping and specific transcriptional responses to different plant hormones in rice. Plant Signaling & Behavior, 2012, 7(8): 951-956.
Goda H, Sasaki E, Akiyama K, et al. The AtGenExpress hormone and chemical treatment data set: experimental design, data evaluation, model data analysis and data access. Plant Journal, 2008, 55(3): 526-542.
Kakei Y, Mochida K, Sakurai T, et al. Transcriptome analysis of hormone-induced gene expression in Brachypodium distachyon. Scientific Reports, 2015, 5: 14476.
Liu C, Mi H, Liu H, et al. Response to water deficit in glume of wheat: expression profiling by microarray analysis. Euphytica, 2017, 213(1): 26.


